Známé neznámé DNA sekvenování - Část II
V první kapitole jsme se věnovali problémům s žádným nebo velmi slabým fluorescenčním signálem. Bylo to v zásadě o prázdných elektroferogramech. Velmi frustrující záležitost. Teď pokročíme k další jen o málo menší nepříjemnosti – v reakcích pozorujeme nějaký signál, ale výška píků rychle klesá. Délka čtení je velmi krátká.
Velmi krátká délka čtení
Výška sekvenačních píků se se vzrůstající vzdáleností od primeru vždy snižuje, to je normální projev sekvenační reakce a nejlépe je to vidět v hrubých datech. Nedoporučuji snažit se tento trend sledovat v elektroferogramu, protože během analýzy dat se používají různé algoritmy, které mimo jiné i normalizují výšku píků, a v závislosti na zvoleném algoritmu můžete tento pokles intenzity signálu v elektroferogramu vidět, ale také nemusíte. Jsou to zkrátka již nějak zpracovaná data. Mimochodem, řešíte-li jakýkoliv problém s kvalitou sekvenování, v některých případech nemusíte prohlížet elektroferogramy, ale vždy musíte prohlížet hrubá (raw) data!
Pokud však výška píků klesá rychleji, než je žádoucí, bude sekvence čitelná pouze na začátku a naopak na jejím konci, kvůli klesajícímu poměru signál:pozadí, dostaneme v zásadě nečitelnou sekvenci, neboť algoritmus pro její odečet (tzv. basecaller) z toho šumu zkrátka nic rozumného nevyčte.
Podobně jako v jiných případech i tento problém může mít různé příčiny.
Nesprávný poměr koncentrací templátu a primeru v sekvenační reakci
Při sekvenování se pracuje s primery v koncentraci 5 mikromolární. Je-li primeru v reakci příliš mnoho, může dojít k jeho nespecifické vazbě a výsledkem je směsná sekvence. Pokud je koncentrace primeru optimální ale množství DNA příliš vysoké, váže se primer na templát „příliš často“. To vede k rychlému vyčerpání dNTPs a častějšímu ukončování syntézy. Množství templátu a primeru tedy má vliv na použitelnou délku čtení.
Příliš mnoho templátu v sekvenační reakci
V zásadě se jedná o stejný problém jako nesprávný poměr primer:templát popsaný výše. Příliš mnoho DNA způsobí prudký pokles signálu, v extrémním případě se reakce vůbec nezdaří. Spotřeba dNTPs je velmi rychlá a tvoří se pouze krátké produkty. Navíc příliš mnoho DNA znamená příliš mnoho fosfátu, takže dojde k chelataci hořečnatých iontů v reakční směsi.
Homopolymery nebo repetice
Pokles signálu můžete někdy pozorovat i při sekvenování homopolymerních úseků nebo repetitivních oblastí. Více k tomuto tématu viz poslední kapitola.
Sole a další inhibitory v sekvenační reakci
Tento problém jsme zmínili již v první kapitole. Přítomnost inhibitorů, nejčastěji solí ale i etanolu, fenolu atd., má negativní vliv na procesivitu polymerázy během sekvenační reakce a může ji úplně zabít. Je-li koncentrace inhibitorů nízká, dostanete nějaký fluorescenční signál, ale velmi rychle klesá.
Abychom ukázali, jak se to projeví v praxi, provedli jsme dvě sekvenační reakce – liší se pouze v koncentraci NaCl, žádný jiný rozdíl tam není. Viz obrázek níže. Povšimněte si klesajícího signálu v jednom z elektroferogramů! Hovoří to samo za sebe.
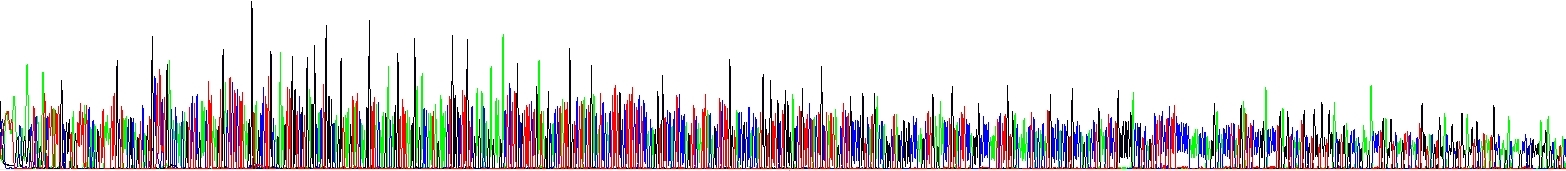
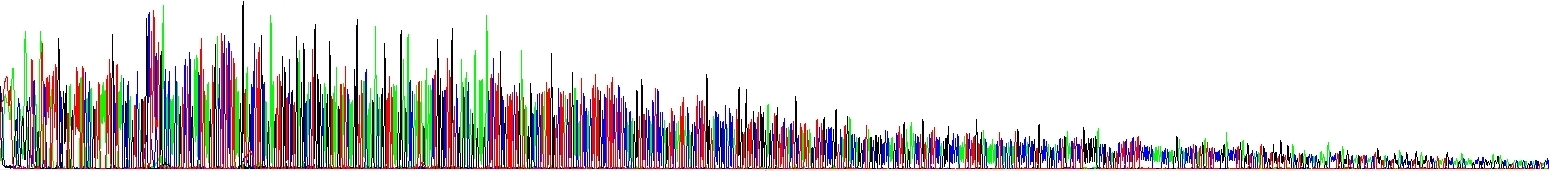
Pokles signálu kvůli vlásenkám
Některé neobvyklé sekvence DNA, zejména vlásenky, inhibují Taq polymerázu. Úspěšně sekvenovat tyto oblasti může být docela výzva. Zaprvé jsou přirozeně stabilní. Zadruhé, sekvenační soupravy namísto dGTP obsahují dITP. Díky dITP dochází k snížení tvorby sekundárních struktur během elektroforézy což vede k lepšímu rozlišení (guanin tvoří tři vodíkové vazby zatímco inozin jen dvě). Aby nedošlo k omylu, v naprosté většině případů dává použití inozinu namísto guaninu lepší výsledky. Ale nevýhodou inozinu je, že není zařazován do rostoucího řetězce tak efektivně jako guanin. Vlásenky tedy brání DNA polymeráze samy o sobě a tím spíš, když se používá inozin. Výsledkem je zpomalení DNA polymerázy a pokles intenzity píků, přičemž čím stabilnější je vlásenka, tím větší pokles intenzity pozorujeme.
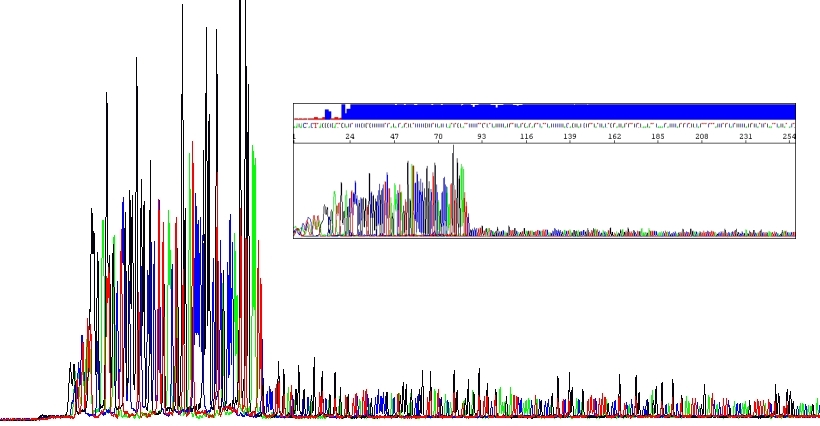
Můžeme teoreticky uvažovat znovu o použití dGTP, ale většinou to moc nepomůže a tento postup vám ani nenabízíme. Mnohem lepší je eliminovat (alespoň částečně) tento problém použitím analogů dNTPs už v PCR reakci. Pokud sekvenujete vlásenky, volte náš HairpinSeq protokol, v jehož ceně je obousměrná sekvenace!