Známé neznámé DNA sekvenování - Část I
Cílem tohoto textu není detailní rozbor všech problémů, na které můžete narazit při vyhodnocování vašich výsledků. Ani by to nemělo smysl, protože jich je příliš mnoho. Naštěstí naprostá většina chybných výsledků vzniká v důsledku několika málo „základních“ chyb, jejichž odstranění není ve většině případů nijak složité, a na ty se zaměříme. Nebudeme se zabývat problémy vzniklými v důsledku chyb hardwaru (sekvenátorů) ani sekvenačních reagencií používaných v naší nebo kterékoliv jiné sekvenační laboratoři, jednoduše proto, že jako uživatelé je stejně nemůžete ovlivnit a je naší zodpovědností dodat vám výsledky v takové kvalitě, abyste tyto potíže ani nezaznamenali.
Text je členěn do tří hlavních kapitol nazvaných podle tří hlavních pozorovaných problematických výstupů. Naneštěstí se různé chyby při zpracování vzorku mohou v konečném důsledku projevit podobným výstupem, takže ačkoliv příčina může být triviální, její nalezení nemusí být přímočaré. První kapitola je věnována případům, kdy získáme velmi slabý nebo vůbec žádný fluorescenční signál, v druhé se zaobíráme situací, kdy signál je sice dobrý, ale velmi rychle klesá a v poslední kapitole řešíme situaci „příliš mnoho píků“.
Žádný nebo velmi slabý signál
Začneme obrázkem:
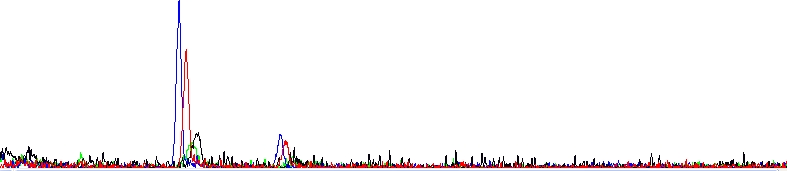
Absolutně mrtvá sekvenační reakce
Jak sami vidíte, nevidíte vůbec nic, jenom dva bloby. Reakce se nezdařila.
Mezi možná vysvětlení v tomto případě patří: nepřidali jste templátovou DNA, přidali jste jí málo a nebo je kontaminována inhibitory blokujícími sekvenační reakci. Nepřidali jste sekvenační primer, přidali jste ho málo a nebo se neváže na templát.
Je celkem užitečné vědět, že pokud se reakce z jakéhokoliv důvodu nezdaří a nebo je signál velmi slabý, často v hrubých datech i elektroferogramu vidíte jeden nebo dva velké píky (někdy nazývané Bloby). Jedná se o zbytkové barevné terminátory, které nebyly odstraněny při přečišťování sekvenační reakce.
V naší laboratoři reakce přečišťujeme stále stejným způsobem, ale čištění nemusí být 100% účinné, pokud se barevné terminátory v reakci nespotřebují na tvorbu sekvenačních produktů. Zbyde jich tam po doběhnutí reakce pořád příliš mnoho a procedura čištění, jindy efektivní, najednou nestíhá. Bloby nejsou tedy chybou samy o sobě, jsou jejím důsledkem. Můžeme rovněž říci, že pokud vidíte ve svých elektroferogramech bloby, zřejmě bylo v reakcích málo templátu.
V závislosti na tom, o jakou chybu se jedná, lze samozřejmě přistoupit k nápravě, ale upřímně řečeno, zde popisovaná situace je přesně ten případ zmíněný v úvodu, protože možných příčin je zkrátka mnoho. Můžeme to přirovnat k situaci, kdy vám nefunguje televize, což může být způsobeno televizí samotnou a stovkami jejích součástek, dálkovým ovladačem, anténou a nebo i elektrickou sítí. A teď to řešte…
Koncentrace templátu: první předpoklad úspěchu
Zaprvé, vždy dodržujte naše doporučení stran koncentrace templátu. Použijete-li příliš málo DNA, je to špatně a projeví se to velmi nízkým nebo slabým signálem, ale použijete-li příliš mnoho, je to také špatně!
Rád bych (možná trochu zbytečně) upozornil, že spektrofotometr není ta úplně nejspolehlivější metoda měření koncentrace DNA. Primery, proteiny i RNA absorbují při 260 nm a mohou tedy způsobit nadhodnocení koncentrace měřené DNA. Velmi doporučujeme agarózové gely. Porovnáním s velikostním DNA standardem získáte mnohem spolehlivější odhad koncentrace DNA a navíc i informaci o její kvalitě. Podotýkám, že Nanodrop je také spektrofotometr (pro většinu čtenářů to nebude překvapení). Pokud nechcete analyzovat vzorky na gelu, doporučujeme Qubit.
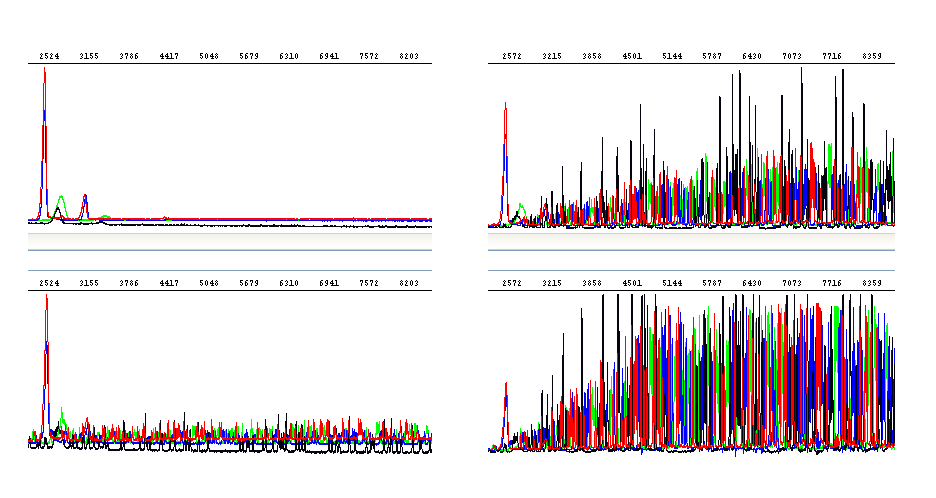
Různá koncentrace templátu: Optimální (vpravo nahoře), příliš vysoká (vpravo dole), příliš nízká (vlevo dole), extrémně nízká (vlevo nahoře)
Řečeno jednou větou, přesné stanovení koncentrace DNA je pro úspěch sekvenační reakce zcela zásadní. Jak uvádíme i v našich pokynech pro přípravu vzorků, objem zasílaných vzorků lze snížit (až na 4 µl), ale koncentrace DNA musí zůstat zachována.
Pokud jste si jisti, že koncentrace DNA je v pořádku, ale problém trvá, zkontrolujte množství sekvenačního primeru. Triviální chybou je jeho špatné ředění. Pokud selhávají reakce pouze s určitým primerem, možná se na templátovou DNA neváže např. kvůli mutaci ve vazebném místě.
Takže znovu, pokud jste si jisti, že koncentrace DNA je v pořádku a nemáte důvod obvinit ani sekvenační primer, jediný další možný závěr je, že ve vzorku jsou nějaké inhibitory sekvenační reakce.
Několik poznámek k čistotě templátů
Dostatečná koncentrace templátu je jednou, nikoliv jedinou podmínkou úspěchu DNA sekvenování. Stejně důležitá je i jeho čistota. Sekvenační reakce je poměrně citlivá na přítomnost různých inhibitorů, většinou ani není doporučeno rozpouštět templáty v různých pufrech (lepší je čistá voda).
Mezi běžné často se vyskytující inhibitory patří především soli, zbytky z různých kitů na přečišťování templátů (např. etanol nebo pozůstatky různých pufrů typicky obsahujících vysoké koncentrace solí), dNTPs (!) atd. Další nečistoty nemusí nutně reakci zabít, ale stejně je žádoucí se jim vyhnout – zejména primery z PCR a nespecifické produkty.
Je tedy nezbytné dobře zvolit metodu čištění templátů. V principu máte k dispozici tři možnosti, a to v závislosti na tom, jak templát vypadá na gelu.
dNTPs mohou způsobit hodně problémů
Jsou-li fluorescenční signály slabé, lze tuto situaci interpretovat i jako příliš vysoké pozadí. V zásadě vidíte čistou a v podstatě pěknou sekvenci, píky jsou však poměrně nízké (což lze pozorovat v hrubých datech – raw data) a pozadí ne nevýznamné. Nejpravděpodobnější vysvětlení je přenos dNTPs z PCR reakce.
Přítomnost zbytkových dNTPs vždy negativně ovlivní průběh sekvenační reakce, protože dojde ke změně poměru dNTPs a ddNTPs v sekvenační směsi, takže se sníží četnost inkorporace fluorescenčně značených ddNTPs, které umožňují vlastní vizualizaci sekvenačních produktů. Jinými slovy, v důsledku nadbytku dNTPs se sníží intenzita fluorescenčního signálu, i když koncentrace templátu i primeru byla dostatečná. Jakkoliv to tedy může být překvapivé, odstranit dNTPs pocházející z kroku PCR reakce je poměrně zásadní.
Troje různé čištění

- Templát (typicky PCR produkt) je na gelu vidět jako jediný pruh o správné velikosti
- Templát je na gelu vidět jako pruh o správné velikosti, ale kromě něj lze pozorovat i další krátké produkty včetně ale nikoliv výhradně primerových dimerů
- Templát je na gelu vidět jako směs relativně velkých pruhů o správné i nežádoucí velikosti
Templát je na gelu vidět jako jediný pruh o správné velikosti
Nejjednodušší a nejúčinnější metodou čištění je směs Exo/SAP (USB nebo vlastní výroba). Exonukleáza I rozštěpí jednořetězcové primery a alkalická fosfatáza defosforyluje zbytkové dNTPs. Je to rychlé, málo pracné a nehrozí ztráta vzorku.
Používáte-li na čištění PCR produktů Exo/SAP, nedoporučujeme doporučený protokol ;-) výrobce (2 µl Exo/SAP na každých 5 µl PCR produktu inkubováno 15 min při 37ºC a tepelně inaktivováno 15 min při 80ºC). Je to relativně drahé a ne úplně efektivní protože příliš rychlé. Raději použijte 1 µl Exo/SAP na každých 10 µl PCR produktu a inkubujte 30–60 min při 37ºC. Rovněž tepelnou inaktivaci lze prodloužit.
Dbejte, abyste nepoužili příliš vysoké koncentrace primerů a/nebo dNTPs v PCR reakci (“pravidlo 200/200” – primery: ne více než 200 nanomolární každý, dNTPs: ne více než 200 mikromolární každý). Použijete-li vyšší koncentrace, je možné, že všechny primery a dNTPs nebudou účinně odstraněny a sekvenační reakci to negativně ovlivní. Více primerů zapříčiní vyšší pozadí v elektroferogramu nebo směsné sekvence, zbytkové dNTPs způsobí slabý signál (viz výše).
Templát je na gelu vidět jako pruh o správné velikosti, ale kromě něj lze pozorovat i další krátké produkty včetně ale nikoliv výhradně primerových dimerů
V tomto případě nelze Exo/SAP použít. Nejčastější zvolená metoda přečištění bude založena na použití nějaké komerční soupravy (kitu) na bázi centrifugačních kolonek. Kolonky musí být zvoleny tak, aby jejich „cut off“ limit umožnil malé fragmenty odstranit a velký žádoucí produkt podržet. Soupravy pro přečišťování PCR produktů nebo plazmidů jsou velmi běžné a snadno dostupné. Není ovšem úplně od věci upozornit na to, že některé centrifugační kolonky mají příhodnější tvar než jiné, což může mít poměrně značný vliv na úspěšné přečištění, jehož zásadní součástí je opakovaná centrifugace v úhlových rotorech.
Předposledním krokem přečištění je stáčení prázdných kolonek jednu až dvě minuty s cílem je vysušit. Poté se přidává eluční pufr a po další krátké centrifugaci se získaný templát odesílá na sekvenování. Naneštěstí v templátu se mohou vyskytovat zbytky etanolu nebo solí z pufrů použitých během přečišťování. Ty měly být samozřejmě odstraněny právě v tom předposledním kroku, ale doby stáčení, doporučované výrobci souprav, jsou většinou příliš krátké a díky tvaru kolonek a jejich sklonu v úhlovém rotoru může dojít k tomu, že tekutiny nejsou dokonale odstraněny při sušení kolonky a kontaminují produkt při eluci. Výsledkem je kontaminovaný vzorek.
Můžete si to poměrně snadno ověřit. Postupujte podle příslušného protokolu, ale těsně před elucí přeneste vnitřní zkumavku do čisté ependorfky a centrifugujte naprázdno 5 min při doporučené rychlosti. Ve většině případů uvidíte na dně ependorfky malý objem tekutiny, zřejmě etanolu (do cca 10 µl). Tento etanol inhibuje sekvenační reakci.
Co s tím? Nejjednodušší je centrifugovat naprázdno takových 3–5 min. Nicméně u některých zkumavek ani to nestačí, protože díky náklonu v úhlovém rotoru v nich zůstává malý „mrtvý“ objem. Doporučujeme proto centrifugovat naprázdno 2 min a poté, aniž zkumavky z rotoru vyjmete, otočit vnitřní zkumavku o 180º a centrifugovat další 2 min. Zachycené tekutiny byste měli tímto způsobem odstranit. Dokonale vysušenou vnitřní zkumavku pak přenesete do čisté jímací zkumavky a pokračujete v eluci podle doporučení výrobce.
Templát je na gelu vidět jako směs relativně velkých pruhů o správné i nežádoucí velikosti
Tady nepomůže nic jiného než izolace z gelu. Není ale od věci zvážit optimalizaci PCR reakce s cílem eliminace nespecifických produktů, protože izolace z gelu většinou nedává při sekvenování dobré výsledky a templáty bývají kontaminovány zbytky různých roztoků použitých při purifikaci, podobně jako v případě přečištění na kolonkách popsaném výše.
Sanger lab, info@seqme.eu