HairpinSeq – protokol pro problematické templáty
Objednali jste si sekvenační analýzu DNA zaklonované do plazmidového vektoru či PCR produktu a výsledná sekvence je ukončena dříve než jste očekávali? Jednou z možných příčin může být skutečnost, že v templátu dochází ke vzniku sekundární struktury, nejčastěji vlásenky.
Některé úseky DNA jsou náchylné ke vzniku nadšroubovicových struktur. Tento problém nastává zvláště tehdy, je-li obsah G+C vyšší než 60 % (ve výjimečných případech i v AT-bohatých úsecích) či u některých vektorů. Provést úspěšnou sekvenační analýzu takového úseku může být poměrně komplikované. Standardní podmínky reakce většinou selhávají, neboť optimální funkčnost polymerázy v těchto oblastech bývá značně omezena, polymeráza zkrátka tímto úsekem neprojde, v krajním případě může daný úsek zcela přeskočit. Ve výsledných hrubých datech lze tento problém rozpoznat tak, že sekvence je náhle a předčasně ukončena (obrázek vlevo). V případě, že došlo alespoň k částečnému pročtení vlásenky, silný elektroforetický signál prudce klesá, sekvence za tímto místem sice pokračuje, signál však už může být příliš slabý (obrázek vpravo).
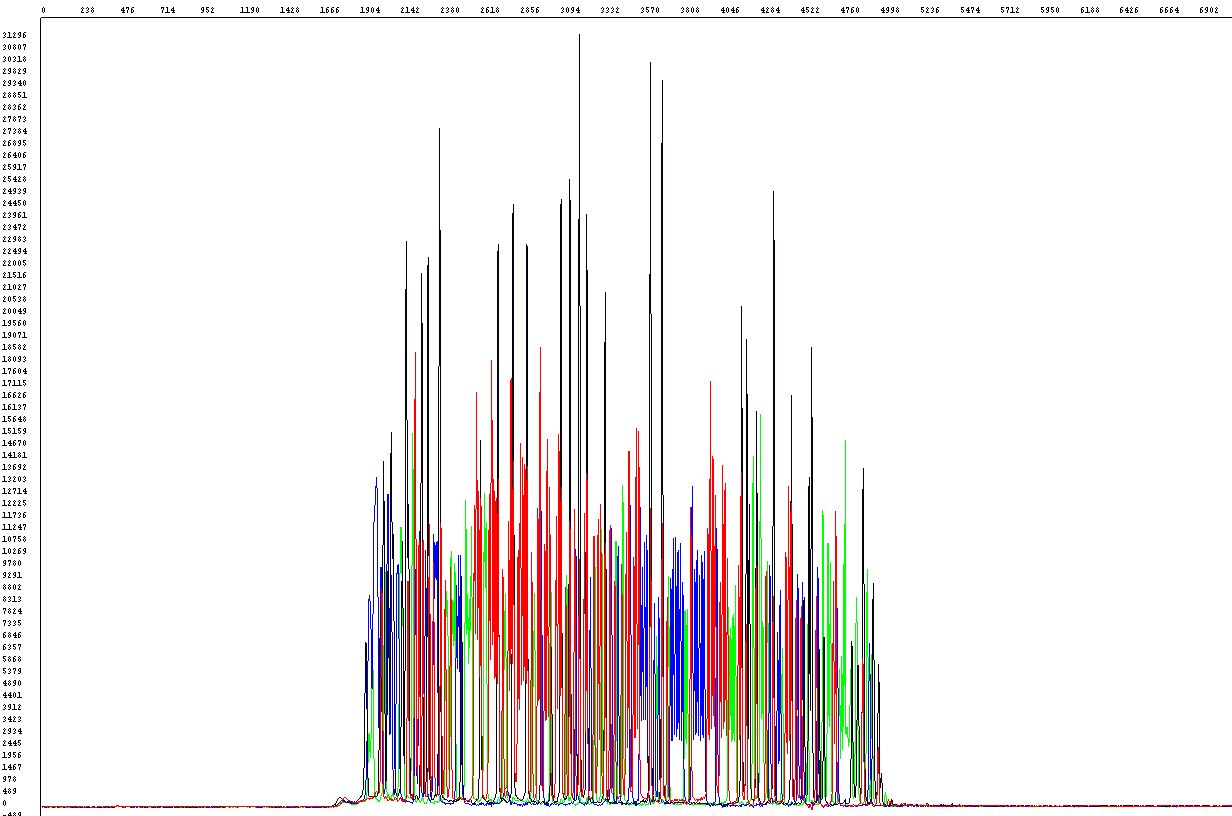
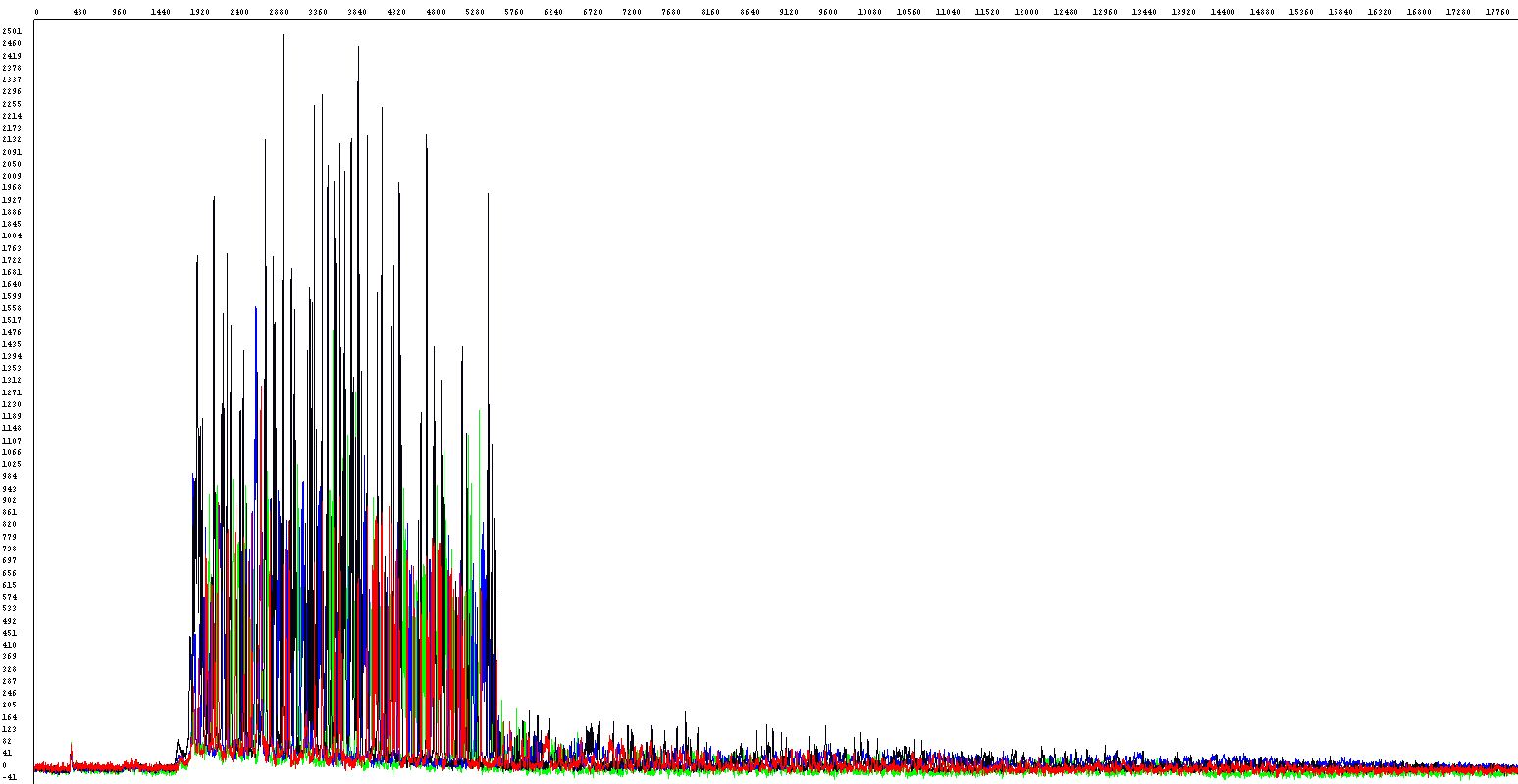
Pro kvalitní pročtení jakékoliv vlásenky v jakémkoliv templátu bohužel neexistuje jeden univerzální zaručený postup, známe však několik možných cest, jak se k úspěšnému výsledku dostat (nebo se o to alespoň pokusit).
První možností jsou denaturační aditiva sekvenační reakce, nejčastěji betaine, DMSO, či formamid, které znesnadňují tvorbu vyšších struktur v řetězci DNA. Alternativou může být také (částečná) náhrada dITP, které jsou běžnou součástí sekvenačních souprav, za dGTP. Výhodou dITP je snížení počtu vodíkových vazeb (ze tří na dvě v páru bazí mezi inozinem a cytozinem), čímž je oslabena stabilita potenciálně vzniklých sekundárních struktur. Nevýhodou pak je zejména problém nedostatečně efektivního začlenění správného nukleotidu polymerázou, zejména při vyšších annealingových teplotách a s rostoucí vzdáleností od primeru. Použití dGTP může být v těchto případech prospěšné, narážíme zde ale na problém, kdy jednotlivé fragmenty nemigrují zcela správně podle své velikosti (právě v důsledku tvorby sekundárních struktur vedoucí ke změně elektroforetické pohyblivosti řetězce DNA) a ve výsledné sekvenci dochází ke kompresi, tedy k překryvu různých fragmentů, resp. píků v daných pozicích sekvence.
Další prospěšnou modifikací může být změna teplotních podmínek sekvenační reakce - zvýšení denaturační teploty, popř. zařazení iniciační denaturace a rovněž navýšení annealingové teploty, které napomáhají udržet templát v jednořetězcové podobě.
Důležitým parametrem je i vhodná volba primeru, zejména s ohledem na vzdálenost od vlásenky. V některých případech může změna forward primeru pomoci (jiná vzdálenost, jiná hybridizační síla), současně se však vždy doporučuje sekvenování analyzovaného úseku primerem reverzním.
V řadě případů se osvědčila i amplifikace vybraného problematického úseku se současnou náhradou části dGTP modifikovanými nukleotidy 7-deaza-dGTP (standardně v poměru 1:3), nejlépe v kombinaci s hot-start technologií PCR reakce. Absence dusíku v 7. pozici purinového cyklu v 7 deaza-dGTP destabilizuje tvorbu sekundárních struktur tím, že brání alternativnímu (tzv. hoogsteenovskému) párování bází, aniž by byla negativně ovlivněna inkorporace správné báze.
Pakliže výše zmíněné postupy problém s vlásenkou neřeší, nabízí se ještě možnost naštěpit vlásenku restrikčními enzymy (ideálně na fragmenty dlouhé do 200bp) s následným subklonováním, čímž se sníží celkový obsah GC nukleotidů v jednotlivých fragmentech a tvorba stabilních sekundárních struktur může být značně omezena. V krajním případě zbývá zkusit osekvenovat problematický úsek Maxam-Gilbertovou (chemickou) metodou.
Pro problematické vzorky tohoto typu vám nabízíme sekvenování protokolem HairpinSeq, který kombinuje různé možnosti zmíněné výše, i některé další. Jeho automatickou součástí je čtení jednoho každého vzorku z obou směrů (pomocí forward i reverse primeru). Jakkoliv můžeme s klidným svědomím říci, že úspěšnost HairpinSeq je vyšší než u protokolu StandardSeq, nelze bohužel garantovat, že pročteme všechno. Úspěch závisí v prvné řadě na sekvenci každého vzorku.
Sanger lab, info@seqme.eu